Materi tentang sistem periodik unsur
Sistem periodik adalah
suatu tabel berisi identitas unsur-unsur yang dikemas secara berkala dalam
bentuk periode dan golongan berdasarkan kemiripan sifat-sifat unsurnya.
Sejarah penyusunan
sistem periodik unsur
Triade Dobereiner
Pada tahun 1829, Johan Wolfgang Dobereiner ,seorang
profesor kimia di Jerman, mengemukakan bahwa massa atom relatif stronsium
sangat dekat dengan massa rata-rata dari dua unsur lain yang mirip stronsium,
yaitu kalsium dan barium. Dobereiner juga menemukan beberapa kelompok unsur
lain mempunyai gejala seperti itu. Oleh karena itu, Dobereiner mengambilan
kesimpulan bahwa unsur-unsur dapat dikelompokan ke dalam kelompok-kelompok tiga
unsur yang disbutnya triade. Namun sayang, Dobereiner tidak berhasil
menunjukkan cukup banyak triade sehingga aturan tersebut tidak bermanfaat.
KELEBIHAN &
KEKURANGAN Pengelompokkan Unsur Menurut Johann Wolfgang Dobereiner
(+) KELEBIHAN :
+ Keteraturan setiap unsur yang
sifatnya mirip massa atom (Ar) unsur yang kedua (Tengah) merupakan massa atom
rata -rata di massa atom unsur pertama dan ketiga
(-) KEKURANGAN
– Kurang efisien karena ada beberapa
unsur lain yang tidak termasuk dalam kelompok Triade padahal sifatnya sama
dengan unsur di dalam kelompok triade tersebut.
Pengelompokkan Unsur Menurut Antoine Lavoisier
•
Lavoiser membagi unsur-unsur dalam
unsur logam dan non logam. Pada waktu itu baru dikenal kurang lebih 33 unsur.
Pengelompokan ini merupakan metode paling sederhana , dilakukan. Pengelompokan
ini masih sangat sederhana karena antara unsur – unsur logam sendiri masih banyak
perbedaan.
Perbedaan Logam dan Non Logam
•
Logam Non Logam Berwujud padat pada
suhu kamar (250), kecuali raksa (Hg)
•
Mengkilap jika digosok
•
Merupakan konduktor yang baik
•
Dapat ditempa atau direnggangkan
•
Penghantar panas yang baik
•
Ada yang berupa zat padat, cair,
atau gas pada suhu kamar
•
Tidak mengkilap jika digosok,
kecuali intan (karbon)
•
Bukan konduktor yang baik
•
Umumnya rapuh, terutama yang
berwujud padat
•
Bukan penghantar panas yang baik
kELEBIHAN & KEKURANGAN Unsur
Menurut Antoine Lavoisier
•
(+) KELEBIHAN :
•
Sudah Mengelompokkan 33 unsur
berdasarkan sifat kima, sehingga bisa dijadikan referensi bagi ilmuwan
setelahnya
•
(-) KELEMAHAN :
•
Pengelompokannya masih terlalu umum
Hukum
Oktaf Newlands
J.W. Newlands merupakan orang yang
mengelompokkan unsur berdasarkan kenaikan massa atom relatif. Pada tahun 1863,
ia menyatakan bahwa sifat sifat unsur berubah secara teratur. Unsur pertama
mirip dengan unsur kedelapan, unsur kedua mirip dengan unsur kesembilan dan
seterusnya.
Gas mulia tidak termasuk dalam pengelompokkan unsur ini karena gas mulia saat itu belum ditemukan.
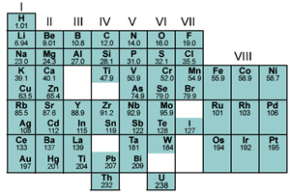
Sistem
Periodik Mendeleev
Diantara para ahli yang dianggap paling berhasil dalam
mengelompokkan unsur-unsur dan berani menduga adanya unsur-unsur yang pada saat
itu belum ditemukan adalah Dmitry Mendeleev. Mendeleev mengelompokkan unsur berdasarkan kenaikan massa
atom relatifnya. Cara pengelompokkan dilakukan dengan menggunakan kartu. Dalam
kartu tersebut ditulis lambang atom, massa atom relatifnya dan sifat-sifatnya.
Mendeleev selanjutnya menempatkan unsur-unsur dengan kemiripan sifat pada satu
lajur vertikal yang disebut golongan. Unsur-unsur juga disusun berdasarkan
kenaikan massa atom relatifnya dan ditempatkan dalam satu lajur yang disebut
periode. Sistem periodik yang disusun Mendeleev dapat dilihat pada tabel
berikut:
Mendeleev sengaja mengosongkan beberapa tempat untuk
menetapkan kemiripan sifat dalam golongan. Beberapa kotak juga sengaja
dikosongkan karena Mendeleev yakin masih ada unsur yang belum dikenal karena
belum ditemukan. Salah satu unsur baru yang sesuai dengan ramalan Mendeleev
adalah germanium yang sebelumnya diberi nama ekasilikon oleh Mendeleev.
Mendeleyef dan Lothar Meyer secara terpisah
menyusun unsur-unsur berdasarkan kenaikan berat atom dan persamaan sifatnya.
Dari data tersebut Mendeleyef mengemukakan Sifat unsur-unsur adalah merupakan
fungsi periodik dari berat atomnya.
Sistem
Periodik Modern dari Hhenry G. Moseley
Pada awal abad 20, setelah penemuan nomor atom, Henry
Moseley menunjukkan bahwa urut-urutan unsur dalam sistem periodik Mendeleev
sesuai dengan kenaikan nomor atomnya. Penempatan telurium (Ar = 128)
dan iodin (Ar = 127) yang tidak sesuai dengan keniakan massa atom
relatif, ternyata sesuai dengan kenaikan nomor atomnya (nomor atom Te = 52; I =
53).
Robert
Boyle adalah orang pertama yang memberikan tentang
definisi bahwa unsur adalah suatu zat yang tidak dapat lagi dibagi-bagi menjadi
dua zat atau lebih dengan cara kimia. Sejak itu orang dapat menyimpulkan bahwa
unsur-unsur mempunyai sifat yang jelas dan ada kemiripan diantara sifat-sifat
unsur itu.
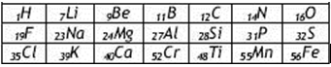
Sistem Periodik Modern
Sistem periodik modern disusun berdasarkan hukum
periodik modern yang menyatakan bahwa sifat-sifat unsur merupakan fungsi
periodik dari nomor atomya. Artinya, jika unsur-unsur disusun berdasarkan
kenaikan nomor atomnya, maka sifat-sifat tertentu akan berulang secara
periodik. Itu sebabnya tabel unsur-unsur tersebut dinamai Tabel
Periodik.
•
Sistem periodik modern tersusun berdasarkan
kenaikan nomor atom dan kemiripan sifat.
•
Lajur horisontal yang
disebut periode, tersusun berdasarkan kenaikan nomor atom sedangkan lajur
vertikal yang disebut golongan tersusun berdasarkan kemiripan sifat.
•
Unsur golongan A disebut golongan utama sedangkan golongan B disebut
golongan transisi.
•
Golongan dapat diberi
tanda nomor 1 sampai 18 berurutan dari kiri ke kanan.
•
Berdasarkan penomoran
ini, golongan transisi mempunyai nomor 3 sampai 12.
•
Sistem periodik modern
tersusun atas 7 periode dan 18 golongan yang terbagi menjadi
8 golongan utama atau golongan A dan 8 golongan transisi atau golongan B.
•
Sistem
periodik modern disusun berdasarkan hukum periodik modern yang menyatakan bahwa
sifat-sifat unsur merupakan fungsi periodik dari nomor atomya. Artinya, jika
unsur-unsur disusun berdasarkan kenaikan nomor atomnya, maka sifat-sifat
tertentu akan berulang secara periodik. Itu sebabnya tabel unsur-unsur tersebut
dinamai Tabel Periodik.
Periode
Lajur-lajur horizontal dalam sistem periodik disebut periode. Sistem periodik modern terdiri atas 7 periode
Periode 1, 2,3 disebut periode pendek karena berisi
relatif sedikit unsur, sedangkan periode 4 dan seterusnya disebut periode
panjang.
Golongan
Kolom-kolom vertikal dalam sistem periodik disebut
golongan. Penempatan unsur dalam golongan berdasarkan kemiripan sifat. Sistem
periodik modern terdiri atas 18 kolom vertikal. Ada dua cara penamaan golongan,
yaitu:
- Sistem 8 golongan. Menurut cara ini, sistem periodik dibagi menjadi 8 golongan yang masing-masing terdiri atas golongan utama (golongan A) dan golongan tambahan (golongan B). Unsur-unsur golongan B disebut juga unsur transisi. Nomor golongan ditulis dengan angka Romawi. Golongan-golongan B terletak antara golongan IIA dan IIIA. Golongan VIIIB terdiri atas 3 kolom vertikal.
- Sistem 18 Golongan. Menurut cara ini, sistem periodik dibagi kedalam 18 golongan, yaitu golongan 1 sampai dengan 18, dimulai dari kolom paling kiri. Unsur-unsur transisi terletak pada golongan 3-12
Beberapa golongan unsur dalam sistem periodik
mempunyai nama khusus, diantaranya:
- Golongan IA : logam alkali (kecuali hidrogen)
- Golongan IIA : logam alkali tanah
- Golongan VIIA : halogen
- Golongan VIIIA : gas mulia
Unsur transisi dan transisi dalam
- Unsur Transisi
Unsur-unsur yang terletak pada golongan-golongan B
disebut unsur transisi atau unsur peralihan. Unsur-unsur tersebut merupakan
peralihan dari golongan IIA ke golongan IIIA, yaitu unsur-unsur yang dialihkan
hingga ditemukan unsur yang mempunyai kemiripan sifat dengan golongan IIIA
- Unsur transisi dalam
Dua baris unsur yang ditempatkan dibagian bawah Tabel
Periodik disebut unsur transisi dalam, yaitu terdiri dari:
- Lantanida, yang beranggotakan nomor atom 57-70 (14 unsur). Ke-14 unsur ini mempunyai sifat yang mirip dengan lantanium (La), sehingga disebut lantanoid atau lantanida
- Aktinida, yang beranggotakan nomor atom 89-102 (14 unsur). Ke-14 unsur ini sangat mirip dengan aktinium, sehingga disebut aktinoida atau aktinida
Semua unsur transisi dalam sebenarnya menempati
golongan IIIB, yaitu lantanida pada periode keenam dan aktinida pada periode
ketujuh. Jadi, golongan IIIB periode keenam dan periode ke tujuh, masing-masing
berisi 15 unsur.
Hubungan Konfigurasi Elektron dengan Sistem Periodik
Hubungan antara letak unsur dalam sistem periodik
dengan konfigurasi elektronnya dapat disimpulkan sebagai berikut.
- Nomor periode sama dengan jumlah kulit
- Nomor golongan sama dengan elektron valensi
Berdasarkan hubungan tersebut, maka letak unsur dalam
sistem periodik dapat ditentukan berdasarkan konfigurasi elektron.
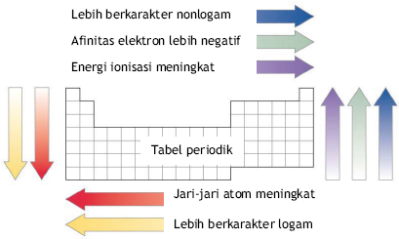
Sifat-sifat Periodik Unsur
Sifat periodik adalah sifat yang berubah secara
beraturan sesuai dengan kenaikan nomor atom, yaitu dari kiri ke kanan dalam
satu periode, atau dari atas ke bawah dalam satu golongan.
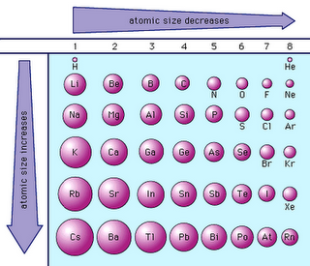
Jari-jari Atom
Jari-jari atom adalah jarak dari inti hingga kulit
elektron terluar. Besar kecilnya jari-jari atom terutama ditentukan oleh dua
faktor, yaitu jumlah kulit dan muatan inti.
- Untuk unsur-unsur segolongan, semakin banyak kulit atom, semakin besar jari-jarinya.
- Untuk unsur-unsur seperiode, semakin besar muatan inti, maka semakin kuat gaya tarik inti terhadap elektron, sehingga semakin kecil jari-jarinya.
Energi Ionisasi
Energi Ionisasi adalah energi yang diperlukan untuk
melepaskan elektron yang terikat paling lemah oleh suatu atom atau ion dalam
wujud gas.
Hubungan energi ionisasi dengan nomor atom.
- dalam satu golongan, dari atas ke bawah, energi ionisasi semakin kecil
- dalam satu periode, dari kiri ke kanan, energi ionisasi cenderung bertambah
Besar kecilnya energi ionisasi bergantung pada
besar gaya tarik inti terhadap elektron kulit terluar, yaitu elektron yang akan
dilepaskan. Semakin kuat gaya tarik inti, semakin besar energi ionisasi
- dalam satu golongan, dari atas ke bawah, jari-jari atom bertambah besar, sehingga gaya tarik inti terhadap elektron terluar semakin lemah. Oleh karena itu, energi ionisasi berkurang
- dalam satu periode, dari kiri ke kanan, jari-jari atom berkurang, sehingga gaya tarik inti terhadap elektron semakin kuat. Oleh karena itu energi ionisasi bertambah
Afinitas Elektron
Afinitas elektron adalah besarnya energi yang dihasilkan atau dilepaskan apabila suatu atom menarik sebuah elektron- Dalam satu golongan dari atas ke bawah, afinitas elektron cenderung berkurang
- Dalam satu periode dari kiri ke kanan, afinitas elektron cenderung bertambah
- Kecuali unsur alkali tanah dan gas mulia, semua unsur golongan utama mempunyai afinitas elektronn bertanda negatif. Afinitas elektron terbesar dimiliki oleh golongan halogen
Keelektronegatifan
Keelektronegatifan adalah kecenderungan suatu atom dalam menarik pasangan elektron yang digunakan bersama dalam membentuk ikatan.Unsur yang mempunyai energi ionisasi dan afinitas elektron yang besar tentu akan mempunyai keelektronegatifan yang besar pula.
Sifat Logam dan Nonlogam
Sifat logam bergantung pada energi ionisasi. Semakin besar energi ionisasi, semakin sukar bagi atom untuk melepas elektron, dan semakin berkurang sifat logamnya.Kereaktifan
Kereaktifan suatu unsur begantung pada kecenderungannya melepas atau menarik elektron. Dari kiri ke kanan dalam satu periode, mula-mula kereaktifan menurun kemudian bertambah hingga golongan VIIA.
Sistem Periodik Mendeleev.
Mendeleev 1869 mengamati 63 unsur yang
dikenal dan mendapat hasil bahwa sifat
unsur merupakan fungsi periodik dari massa atom relatifnya. Sifat tertentu akn
berulang scr periodik bila unsur unsur disusun sesuai kenaikan massa atom relatifnya.
Mendeleev menempatkan unsur-unsur dgn
kemiripan sifat pd satu lajur vertikal yg disebut golongan.
Logam transisi adalah kelompok unsur kimia
yang berada pada golongan 3 sampai 12 (IB sampai VIIIB pada sistem lama).
Kelompok ini terdiri dari 38 unsur. Semua logam transisi adalah unsur
blok-d yang berarti bahwa elektronnya
terisi sampai orbit d. Dalam ilmu kimia, logam transisi mempunyai dua
pengertian:
- Definisi dari IUPAC[1] mendefinisikan logam transisi sebagai "sebuah unsur yang mempunyai subkulit d yang tidak terisi penuh atau dapat membentuk kation dengan subkulit d yang tidak terisi penuh"
- Sebagian besar ilmuwan mendefinisikan "logam transisi" sebagai semua elemen yang berada pada blok-''d'' pada tabel periodik (semuanya adalah logam) yang memasukkan golongan 3 hingga 12 pada tabel periodik. Dalam kenyataan, barisan blok-f lantanida dan aktinida juga sering dianggap sebagai logam transisi dan disebut "logam transisi dalam".
Sifat logam bergantung pada energi ionisasi. Semakin
besar energi ionisasi, semakin sukar bagi atom untuk melepas elektron, dan
semakin berkurang sifat logamnya.
Selisih Keelektronegativan
•
Pauling mendefinisikan perbedaan
keelektronegativan antara dua atom A dan B sebagai perbedaan energi ikatan
molekul diatomik AB, AA dan BB

•
D(A-B), D(A-A) dan D(B-B) adalah energi
ikatan masing-masing untuk AB, AA dan BB ,
D(A-B) lebih besar daripada rata-rata geometri
D(A-A) dan D(B-B). Hal ini karena molekul hetero-diatomik lebih stabil daripada
molekul homo-diatomik karena kontribusi struktur ionik
Dengan menggunakan nilai ini, Pauling mendefinisikan
keelektronegativan x sebagai ukuran atom menarik elektron.
xA dan xB adalah keelektronegativan atom A dan B.
Contoh penentuan golongan utama
Golongan Utama
Dasar Penentuan golongan : elektron valensi
1. Blok S
SX
à
Golongan X A
Contoh
: 12Mg = 1S2 2S2 2P6 3S2 à
Golongan II A
2. Blok P
SX Py à
Golongan (X + Y )A
Contoh
: 15P = 1S2 2S2 2P6 3S2 3P3 à
Golongan V A
Golongan
Transisi disebut dengan
1. Blok d (transisi dalam )
SX dy à ( X + Y ) B untuk 3 ≤ x+y < 7
VIII B untuk 8 ≤ x+y < 10
I B untuk x+y = 11
II B untuk x+y = 12
2. Blok f (transisi luar )
4f à Lantanida (II B)
5f à aktinida (III B)
PERIODE
Periode ditunjukan dengan nomor kulit yang paling
besar (dari 1 sampai 7)
Contoh
•
1.
Unsur dengan nomor atom 11, konfigurasinya : 1s2 2s2
2p6 3s1
- n = 3, berarti periode 3 (kulit M).
- elektron valensi (terluar) 3s sebanyak 1 elektron, berarti termasuk golongan IA.
- n = 3, berarti periode 3 (kulit M).
- elektron valensi (terluar) 3s sebanyak 1 elektron, berarti termasuk golongan IA.
•
2.
Unsur Ga dengan nomor atom 31, konfigurasinya : 1s2 2s2
2p6 3s2 3p6 4s2 3d10 4p1
- n = 4, berarti perioda 4 (kulit N).
- elektronvalensi 4s2 4p1, berarti golongan IIIA.
- n = 4, berarti perioda 4 (kulit N).
- elektronvalensi 4s2 4p1, berarti golongan IIIA.
•
3.
Unsur Sc dengan nomor atom 21, konfigurasinya : 1s2 2s2
2p6 3s2 3p6 4s2 3d1
- n = 4, berarti perioda 4 (kulit N).
- 3d1 4s2 berarti golongan IIIB.
- n = 4, berarti perioda 4 (kulit N).
- 3d1 4s2 berarti golongan IIIB.
•
4.
Unsur Fe dengan nomor atom 26, konfigurasinya : 1s2 2s2
2p6 3s2 3p6 4s2 3d10
- n = 4, berarti perioda 4 (kulit N).
- 3d6 4s2 , berarti golongan VIII.
- n = 4, berarti perioda 4 (kulit N).
- 3d6 4s2 , berarti golongan VIII.
Soal
latihan
• Unsur- unsur dengan nomor atom 24 dan 37 termasuk
unsur golongan berapa dan blok mana?
• . Mengapa Unsur golongan III A sampai VIII A disebut
unsur blok p?
• Sebutkan
semua unsur-unsur golongan A?



Tidak ada komentar:
Posting Komentar