Materi kimia fisika 1
Nama
: Rosanni Sinurat
Nim
: 1416150011
Dosen Pembimbing : Leony S.L.Purba.Mpd
Hukum Hess
Hukum Hess juga berbunyi :
“Entalpi reaksi tidak tergantung pada jalan reaksi melainkan tergantung
pada hasil akhir reaksi”.
Dari Hukum Hess tersebut, perubahan entalpi suatu reaksi
mungkin untuk dihitung dari perubahan entalpi reaksi lain yang nilainya sudah
diketahui. Hal ini dilakukan supaya tidak usah dilakukan eksperimen setiap
saat.
Hukum Hess dapat digambarkan secara skematis sebagai
berikut. [3]
Diketahui diagram Hess reaksi
A → C
Perubahan A menjadi C dapat
berlangsung 2 tahap.
Tahap I (secara Iangsung)
A → C → ∆H1
Tahap II (secara tidak langsung)
Berdasarkan Hukum Hess maka
harga ∆H1 = ∆H2 + ∆H3
|
A → B
|
∆H2
|
|
|
B → C
|
∆H3
|
|
|
A → C
|
∆H2 +
H3
|
Banyak reaksi dapat berlangsung menurut dua atau lebih tahapan.
Kalorimetri
Kalorimetri adalah ilmu dalam pengukuran panas
dan reaksi kimia atau perubahan fisik. Pada kalorimetri ini dapat melakukan
pengukuran perubahan kalor yang bergantung pada pemahaman tentang kalor jenis
dan kapasitas kalor. Dengan demikian kita dapat mengetahui suhu pada suatu
ruangan atau benda-benda lainnya.
Kalorimetri adalah
ilmu dalam pengukuran panas dan reaksi kimia atau perubahan fisik. Pada
kalorimetri ini dapat melakukan pengukuran perubahan kalor yang bergantung pada
pemahaman tentang kalor jenis dan kapasitas kalor. Dengan demikian kita dapat
mengetahui suhu pada suatu ruangan atau benda-benda lainnya. pengukuran panas
ini sangat bermanfaat diberbagai bidang, salah satunya adalah kesehatan.
Kalor Jenis dan Kapasitas Kalor[
Kalor jenis suatu zat
adalah jumlah kalor yang dibutuhkan untuk menaikkan suhu satu gram zat sebesar
satu derajat Celsius. Kapasitas kalor suatu zat adalah jumlah kalor yang
dibutuhkan untuk menaikkan suhu sejumlah zat sebesar satu derajat Celsius. Hubungan
kapasitas kalor dan kalor jenis suatu zat adalah C=ms dimana m
adalah massa zat dalam gram.
Dalam sebuah percobaan yang sering
dilakukan besar kecilnya kalor yang dibutuhkan suatu benda(zat) bergantung pada
3 faktor :
1.
massa zat
2.
jenis zat (kalor jenis)
3.
perubahan suhu
Dapat dirumuskan:
Q= m.c(t2-t1)
keterangan:
Q adalah kalor yang
dibutuhkan (J)
m adalah massa banda
(kg)
c adalah kalor jenis
(J/kgC)
(t2-t1) adalah
perubahan suhu
Rumus kapasitas kalor:
H=Q/(t2-t1)
Keterangan:
H adalah kapasitas kalor
Q adalah kalor yang dibutuhkan (J)
(t2-t1) adalah perubahan suhu.
Batas-batas
Hukum termodinamika II
ü Menurut
clausius
Sifatnya
reversibel (bolak-balik) entropi di alam semesta tidak akan berkurang dan tidak
bertambah.Kalor yang di lepaskan dari suhu rendah ke suhu tinggi akan
membutuhkan usaha.
ü Menurut
Calvin Plank
Tidak
semua kalor yang di serap dari lingkungan di ubah menjadi energi.
NB: Proses dalam
Termodinamika cenderung tidak teratur ukuran ketidakteraturannya disebut
Entropi (S) di pengaruhi oleh kalor yang di
terima dan di keluarkan.
Hukum Gay lussac (Hukum perbandingan volume)
bunyi hukum tersebut adalah : "Bila di ukur pada suhu dan tekanan yang sama, volume gas gas yang bereaksi dan volume gas gas hasil reaksi berbanding sebagai bilangan bulat dan sederhana"
Hukum gay lussac di dasari oleh hasil penemuan ahli kimia inggris yang bernama Henry Cavendish (1731-1810)bahwa perbandingan volume gas hidrogen yang bereaksi dengan gas oksigen membentuk air adalah 2:1 dengan syarat harus di ukur pada suhu dan tekanan yang sama.pada tahun 1808, Joseph Louis Gay Lussac melakukan percobaan serupa dengan menggunakan berbagai macam gas. Ia menemukan bahwa perbandingan vo- lume gas-gas dalam reaksi selalu merupakan bilangan bulat sederhana.
2 volume gas hidrogen + 1 volume gas oksigen → 2 volume uap air
1 volume gas nitrogen + 3 volume gas hidrogen → 2 volume gas amonia
1 volume gas hidrogen + 1 volume gas klorin → 2 volume gas hidrogen klorida
dari hasil percobaan inilah gay lussac mengemukakan hukumnya.
bunyi hukum tersebut adalah : "Bila di ukur pada suhu dan tekanan yang sama, volume gas gas yang bereaksi dan volume gas gas hasil reaksi berbanding sebagai bilangan bulat dan sederhana"
Hukum gay lussac di dasari oleh hasil penemuan ahli kimia inggris yang bernama Henry Cavendish (1731-1810)bahwa perbandingan volume gas hidrogen yang bereaksi dengan gas oksigen membentuk air adalah 2:1 dengan syarat harus di ukur pada suhu dan tekanan yang sama.pada tahun 1808, Joseph Louis Gay Lussac melakukan percobaan serupa dengan menggunakan berbagai macam gas. Ia menemukan bahwa perbandingan vo- lume gas-gas dalam reaksi selalu merupakan bilangan bulat sederhana.
2 volume gas hidrogen + 1 volume gas oksigen → 2 volume uap air
1 volume gas nitrogen + 3 volume gas hidrogen → 2 volume gas amonia
1 volume gas hidrogen + 1 volume gas klorin → 2 volume gas hidrogen klorida
dari hasil percobaan inilah gay lussac mengemukakan hukumnya.
Avogadro pada tahun
1811. Hipotesis Avogadro menyatakan bahwa dua sampel gas ideal dengan volume,
suhu, dan tekanan yang sama, maka akan mengandung molekul yang jumlahnya sama.
Contohnya adalah, ketika hidrogen dan nitrogen dengan volume yang sama
mengandung jumlah molekul yang sama ketika mereka berada pada suhu dan tekanan
yang sama. Avogadro menyebut partikel sebagai molekul.
Untuk suatu massa dari
gas ideal, volume dan mol gas secara langsung akan proporsional jika suhu dan
tekanannya konstan. Persamaan tersebut dapat ditulis sebagai berikut:
atau
Dimana:
V adalah volume gas
n adalah jumlah zat dari gas (dalam satuan mol)
k adalah konstanta yang
sama dengan RT/P, di mana R adalah konstanta gas universal, T adalah suhu
Kelvin, dan P adalah tekanan. Sebagai suhu dan tekanan yang konstan, RT/P juga
konstan dan disebut sebagai k. Ini berasal dari hukum gas ideal.
Hukum ini menjelaskan
bagaimana dalam kondisi suhu, tekanan, dan volume gas yang sama pasti
mengandung jumlah molekul yang sama. Untuk membandingkan substansi yang sama di
bawah dua set yang kondisinya berbeda, hukum ini dapat dinyatakan sebagai
berikut:
Persamaan ini menunjukkan bahwa, jika
jumlah mol gas meningkat, volume gas juga akan meningkat secara proporsional.
Dan sebaliknya, jika jumlah mol gas berkurang, maka volume juga menurun.
Dalam kimia, hukum
perbandingan tetap atau hukum
Proust (diambil dari namakimiawan Perancis Joseph
Proust) adalah hukum yang menyatakan bahwa suatusenyawa kimia terdiri
dari unsur-unsur dengan
perbandingan massa yang
selalu tepat sama. Dengan kata lain, setiap sampel suatu senyawa memiliki
komposisi unsur-unsur yang tetap. Misalnya, air terdiri dari 8/9 massa oksigen dan 1/9 massahidrogen.
Bersama dengan hukum
perbandingan berganda (hukum
Dalton), hukum perbandingan tetap adalah hukum dasar stoikiometri.
Dari hasil
eksperimen yang dilakukan Joseph Louis Proust (1807)
ditemukan fakta sebagai berikut:Perbandingan massa unsur-unsur
dalam setiap senyawa adalah selalu tetap. Inilah yang menjadi
salah satu hukum dassar kimia yang kemudian dikenal sebagai Hukum Perbandingan Tetap atau Hukum Proust. Perhatikan
data reaksi hidrogen dan oksigen menghasilkan air berikut!.
ENERGI BEBAS GIBBS
Termodinamika klasik
meliputi keadaan kesetimbangan dinamis. Keadaan lokal dari suatu sistem pada
kesetimbangan termodinamika ditentukan oleh nilai dari parameter intensifnya,
seperti tekanan dan suhu.
•
Menunjukkan
perubahan entropi total dari sistem
•
Batasan
à suhu dan tekanan tetap
G = H – TS
DG = DH – TDS (suhu tetap)
DG = - TDS (tekanan tetap)
•
Energi
Bebas Gibbs (DG) digunakan u menggambarkan perub energi sistem, Pada
temperatur dan tekanan konstan, DG = Energi bebas Gibbs
Untuk menentukan kespontanan reaksi dengan fokus hanya pada system.
Penentuan Perubahan Entalpi (∆H) Reaksi Dengan Hukum Hess
Perubahan suhu yang menyertai reaksi kimia menunjukan adanya perubahan energi dalam bentuk kalor pada pereaksi dan hasil reaksi. Kalor yang diserap akan dibebaskan oleh sistem menyebabkan suhu sistem berubah. Secara sederhana kalor tersebut dapat dihitung dengan rumus :
q = m. c. ∆t.
Dimana:
q = kalor reaksi
(Q) m
= massa sistem (gram)
∆t = perubahan suhu (oC,
K) c = kalor jenis sistem
(j/g.K)
Perubahan entalpi (∆H) reaksi adalah q untuk jumlah
mol pereaksi/hasil reaksi sesuai persamaan reaksi, disertai tanaada positif
(reaksi endoterm) negatif (rekasi eksoterm).
Hukum Hess adalah sebuah hukum dalam kimia fisik untuk
ekspansi Hess dalamsiklus Hess. Hukum ini digunakan untuk memprediksi perubahan
entalpi dari hokum kekekalan energi (dinyatakan sebagai fungsi keadaan ΔH)
. Menurut hukum Hess , karena entalpi adalah fungsi keadaan,
perubahan entalpi dari suatu reaksi kimia adalah sama, walaupun langkah-langkah
yang digunakan untuk memperoleh produk berbeda.
Jika
perubahan kimia terjadi oleh beberapa jalur yang berbeda, perubahan entalpi
keseluruhan tetaplah sama. Hukum Hess menyatakan bahwa entalpi merupakan fungsi
keadaan. Dengan demikian ΔH untuk reaksi tunggal dapat dihitung dengan:
ΔHreaksi = ∑ ΔHf (produk) - ∑
ΔHf (reaktan)
Jika
perubahan entalpi bersih bernilai negatif (ΔH < 0), reaksi tersebut
merupakan eksoterm dan bersifat spontan. Sedangkan jika bernilai positif (ΔH
> 0), maka reaksi bersifat endoterm. Entropimempunyai peran yang penting
untuk mencari spontanitas reaksi, karena beberapa reaksi dengan entalpi positif
juga bisa bersifat spontan.
Jenis-Jenis
Perubahan Entalpi
Perubahan entalpi yang
diukur pada suhu 25 oC dan tekanan 1 atm ( keadaan standar)
disebut perubahan entalpi standar ( dinyatakan dengan
tanda DHo atau DH298 ).
Perubahan entalpi yang
tidak merujuk pada kondisi pengukurannya dinyatakan dengan
lambang DH saja.
Entalpi molar =
perubahan entalpi tiap mol zat ( kJ / mol ).
Perubahan entalpi,
meliputi :
a. Perubahan
Entalpi Pembentukan Standar ( DHf o ) = kalor pembentukan
Adalah
perubahan entalpi yang terjadi pada pembentukan 1 mol
senyawa dari unsur-unsurnya pada suhu dan tekanan standar (
25 oC, 1 atm ). Entalpinya bisa dilepaskan maupun diserap.
Satuannya adalah kJ / mol.
Bentuk
standar dari suatu unsur adalah bentuk yang paling stabil dari unsur itu
pada keadaan standar ( 298 K, 1 atm ).
Jika perubahan entalpi
pembentukan tidak diukur pada keadaan standar maka dinotasikan dengan DHf
Contoh :
Catatan :
DHf unsur bebas = nol
Dalam
entalpi pembentukan, jumlah zat yang dihasilkan adalah 1 mol.
Dibentuk dari
unsur-unsurnya dalam bentuk standar.
b. Perubahan
Entalpi Penguraian Standar ( DHd o )
Adalah
perubahan entalpi yang terjadi pada penguraian 1 mol senyawamenjadi
unsur-unsur penyusunnya pada keadaan standar.
Jika
pengukuran tidak dilakukan pada keadaan standar, maka dinotasikan
dengan DHd. Satuannya = kJ / mol.
Perubahan
entalpi penguraian standar merupakan kebalikan dari perubahan entalpi
pembentukan standar, maka nilainya pun akan berlawanan tanda.
Menurut Marquis
de Laplace, “ jumlah kalor yang dilepaskan pada pembentukan senyawa dari
unsur-unsur penyusunnya = jumlah kalor yang diperlukan pada penguraian senyawa
tersebut menjadi unsur-unsur penyusunnya. “ Pernyataan ini disebut Hukum
Laplace.
Contoh :
Diketahui
DHf o H2O(l) = -286 kJ/mol, maka entalpi penguraian H2O(l) menjadi
gas hidrogen dan gas oksigen adalah +286 kJ/mol.
c. Perubahan
Entalpi Pembakaran Standar ( DHc o )
Adalah perubahan
entalpi yang terjadi pada pembakaran 1 mol suatu zatsecara sempurna pada
keadaan standar.
Jika
pengukuran tidak dilakukan pada keadaan standar, maka dinotasikan
dengan DHc. Satuannya = kJ / mol.
Contoh :
d. Perubahan
Entalpi Netralisasi Standar ( DHn o )
Adalah perubahan
entalpi yang terjadi pada penetralan 1 mol asam oleh basa atau 1
mol basa oleh asam pada keadaan standar.
Jika pengukuran tidak
dilakukan pada keadaan standar, maka dinotasikan dengan DHn. Satuannya
= kJ / mol.
Contoh :
DHn reaksi = -200
kJ
DHn NaOH = -200 kJ
/ 2 mol = -100 kJ/mol
DHn H2SO4 =
-200 kJ / 1 mol = -200 kJ/mol
e. Perubahan
Entalpi Penguapan Standar ( DHovap)
Adalah perubahan
entalpi yang terjadi pada penguapan 1 mol zat dalam fase cair menjadi
fase gas pada keadaan standar.
Jika pengukuran tidak
dilakukan pada keadaan standar, maka dinotasikan dengan DHvap. Satuannya
= kJ / mol.
Contoh :
f. Perubahan
Entalpi Peleburan Standar ( DHofus )
Adalah perubahan entalpi
yang terjadi pada pencairan / peleburan 1 mol zat dalam fase
padat menjadi zat dalam fase cair pada keadaan standar.
Jika pengukuran tidak
dilakukan pada keadaan standar, maka dinotasikan dengan DHfus. Satuannya
= kJ / mol.
Contoh :
g. Perubahan Entalpi
Sublimasi Standar ( DHosub )
Adalah perubahan
entalpi yang terjadi pada sublimasi 1 mol zat dalam fase
padat menjadi zat dalam fase gas pada keadaan standar.
Jika pengukuran tidak
dilakukan pada keadaan standar, maka dinotasikan dengan DHsub. Satuannya
= kJ / mol.
Contoh :
h. Perubahan
Entalpi Pelarutan Standar ( DHosol ) Adalah perubahan entalpi yang terjadi
ketika 1 mol zat melarut dalam suatu pelarut ( umumnya air ) pada
keadaan standar.
Jika pengukuran tidak
dilakukan pada keadaan standar, maka dinotasikan dengan DHsol. Satuannya
= kJ / mol.









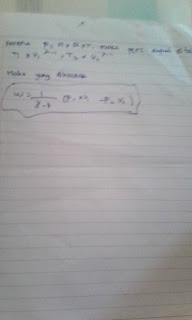

WAU.....MATERI KIMIA FISIK TERBAIK, TRIMS BANYAK ATAS KESEDIAAN MATERI YANG DIBERIKAN...BLOG INI SANGAT MEMBANTU UNTUK MENCARI TAHU LEBIH BANYAK PENGETAHUAN MENGENAI KIMIA FISIKA.
BalasHapus